中学3年理科。イオンと化学変化で基本となる電解質の電離について学習します。
- レベル★★☆☆
- 重要度★★★★
- ポイント:電離のようすを表す式「電離式」をマスター!
授業用まとめプリントは下記リンクからダウンロード!
授業用まとめプリント「電解質の電離」
電離のようすを表す式「電離式」
電解質である物質が水に溶けて、電離するようすを式に表したものを電離式といいます。これが書けるようになることがイオンと化学変化を攻略するポイントになります。意味をしっかり理解して書けるようになってください。
式の左側に電解質である物質の化学式を書きます。次に矢印を書いて、右側には陽イオン+陰イオンの順番でイオン式を書きます。このとき、イオンの価数に注意して書くことになります。具体的な物質の電離で練習しましょう。
電解質→陽イオン+陰イオン
〇〇△△→〇〇⁺+△△⁻

塩化ナトリウム(食塩)の電離
塩化ナトリウム(食塩)の化学式はNaClでした。これを水に溶かすと、ナトリウム原子Naが電子を1つ失い、陽イオンであるナトリウムイオンNa⁺になります。塩素原子Clは電子を1つ受けとり、塩化物イオンCl⁻になります。これを化学式とイオン式で表すと、次のようになります。
塩化ナトリウム→ナトリウムイオン+塩化物イオン
NaCl → Na⁺ + Cl⁻

化学式の前にあるNaが陽イオン、後のClが陰イオンになります。
塩化水素(塩酸)の電離
気体の塩化水素の化学式はHClでした。これを水に溶かすと、水素原子Hが電子を1つ失い、陽イオンである水素イオンH⁺になります。塩素原子Clは電子を1つ受けとり、塩化物イオンCl⁻になります。これを化学式とイオン式で表すと、次のようになります。
塩化水素→水素イオン+塩化物イオン
HCl → H⁺ + Cl⁻

化学式の前にあるHが陽イオン、後のClが陰イオンになります。塩化水素が水に溶けると水溶液の塩酸になります。つまり、塩酸の溶質は気体の塩化水素になるのです。
水酸化ナトリウムの電離
水酸化ナトリウムの化学式はNaOHでした。これを水に溶かすと、ナトリウム原子Naが電子を1つ失い、陽イオンであるナトリウムイオンNa⁺になります。原子のかたまりであるOHは電子を1つ受けとり、水酸化物イオンOH⁻になります。これを化学式とイオン式で表すと、次のようになります。
水酸化ナトリウム→ナトリウムイオン+水酸化物イオン
NaOH → Na⁺ + OH⁻

化学式の前にあるNaが陽イオン、後のOHが陰イオンになります。OHは一つのかたまりとしてみてください。
塩化銅の電離
塩化銅の化学式はCuCl₂でした。Clの後に2がつくことを忘れないようにしましょう。銅原子1つに対し、塩素原子が2つの割合でくっついたものが塩化銅です。これを水に溶かすと、銅原子Cuが電子を2つ失い、陽イオンである銅イオンCu²⁺になります。2つの塩素原子Clは電子をそれぞれ1つずつ受けとり、塩化物イオンCl⁻になります。これを化学式とイオン式で表すと、次のようになります。
塩化銅→銅イオン+塩化物イオン
CuCl₂ → Cu²⁺ + 2Cl⁻
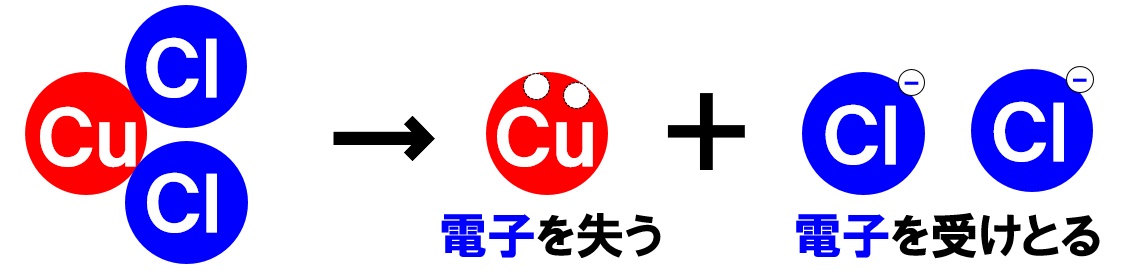
化学式の前にあるCuが2価の陽イオン、後のClが陰イオンになります。銅イオン1個に対して、塩化物イオン2個が生じることも重要です。
また、銅イオンCu²⁺が水溶液中にあれば、その水溶液は青色になります。したがって、塩化銅水溶液は青色の水溶液になります。
硫酸の電離
硫酸の化学式はH₂SO₄でした。これを水に溶かすと、2つの水素原子Hが電子をそれぞれ1つずつ失い、陽イオンである水素イオンH⁺が2つ生じます。原子のかたまりであるSO₄は電子を2つ受けとり、硫酸イオンSO₄²⁻になります。これを化学式とイオン式で表すと、次のようになります。
硫酸→水素イオン+硫酸イオン
H₂SO₄ → 2H⁺ + SO₄²⁻
化学式の前にあるHが陽イオン、後のSO₄が陰イオンになります。SO₄は一つのかたまりとしてみてください。
次の物質の電離のようすを、イオン式と化学式で書きなさい。
(1)塩化水素
(2)水酸化ナトリウム
(3)硫酸
(4)塩化銅
解答(1)HCl→H⁺+Cl⁻
(2)NaOH→Na⁺+OH⁻
(3)H₂SO₄→2H⁺+SO₄²⁻
(4)CuCl₂→Cu²⁺+2Cl⁻


コメント