中学3年理科。イオンと化学変化で登場する化学電池について学習します。
- レベル★★★☆
- 重要度★★★★
- ポイント:電池の極と電子・電流の向きをマスター!
授業用まとめプリントは下記リンクよりダウンロード!
授業用まとめプリント「化学電池」
化学電池(電池)
化学電池とは、化学変化により、化学エネルギーを電気エネルギーとしてとり出す装置です。みなさんも使ったとことはありますよね。普段の生活で浸かっている乾電池などです。電池の中には、他のエネルギーに変換できるエネルギーが詰まっています。これは、化学変化で取り出すことができるので化学エネルギーと呼ばれています。化学電池では、これを電気エネルギーに変換してとり出しているのです。
電池 化学エネルギー → 電気エネルギー
化学電池をつくる
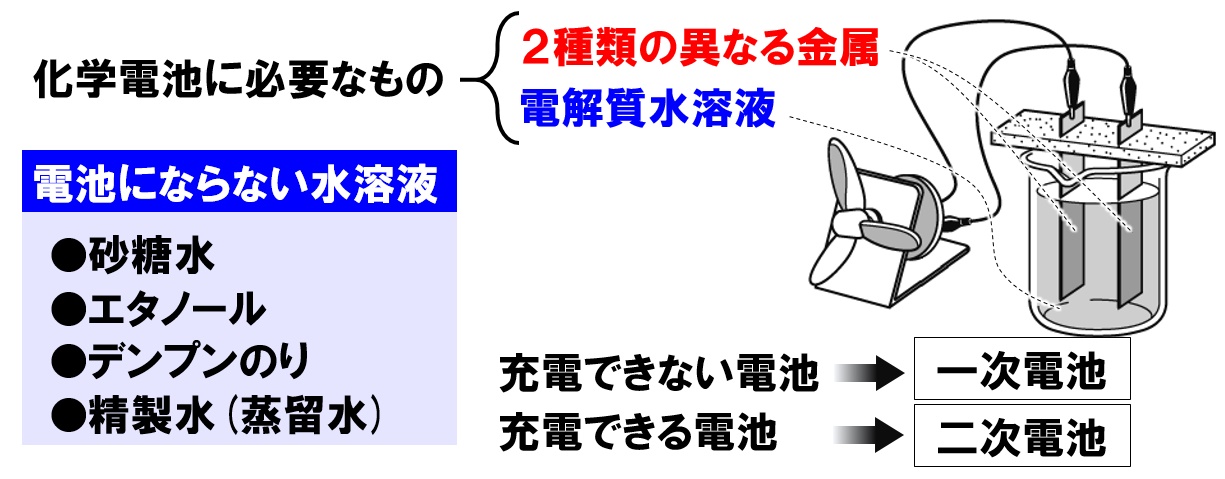
化学電池は、身近にある物質で簡単に作ることができます。準備するものは次の2つです。
- 2種類の異なる金属
- 電解質水溶液
まずは「2種類の異なる金属」ですが、言い方を変えると、イオン化傾向が異なる2つの金属になります。イオン化傾向が異なると金属間で化学変化が生じます。なので、銅と亜鉛、鉄とアルミニウムなど、2種類の金属を準備しましょう。
次に、電解質が溶けた水溶液である「電解質水溶液」ですが、実は電解質水溶液はたくさんあります。例えば、塩酸や炭酸水、食塩水、水酸化ナトリウム水溶液などなど、非常に多くの種類があります。レモンの汁や、ミカンの汁でさえ電解質水溶液です。
電解質水溶液ではないもを覚えるようにしましょう。こちらの方が数が少なく覚えやすいです。次の水溶液は、水に溶けても電離しない(イオンが生じない)非電解質の水溶液です。
- 砂糖水
- エタノール
- デンプンのり
もちろん、何も溶けていない、蒸留水(精製水)なども、電池になりません。
一次電池と二次電池
電池の種類には、電流を流す放電だけではなく、充電ができる電池もあります。携帯電話や自動車のバッテリーなどは充電ができる電池が入っています。
充電ができない電池を「一次電池」、充電ができる電池を「二次電池」だということも覚えておきましょう。具体的な電池は、次の通りです。
- 一次電池…マンガン乾電池、アルカリ乾電池など
- 二次電池…ニッケル水素電池、リチウムイオン電池、鉛蓄電池
化学電池内での変化
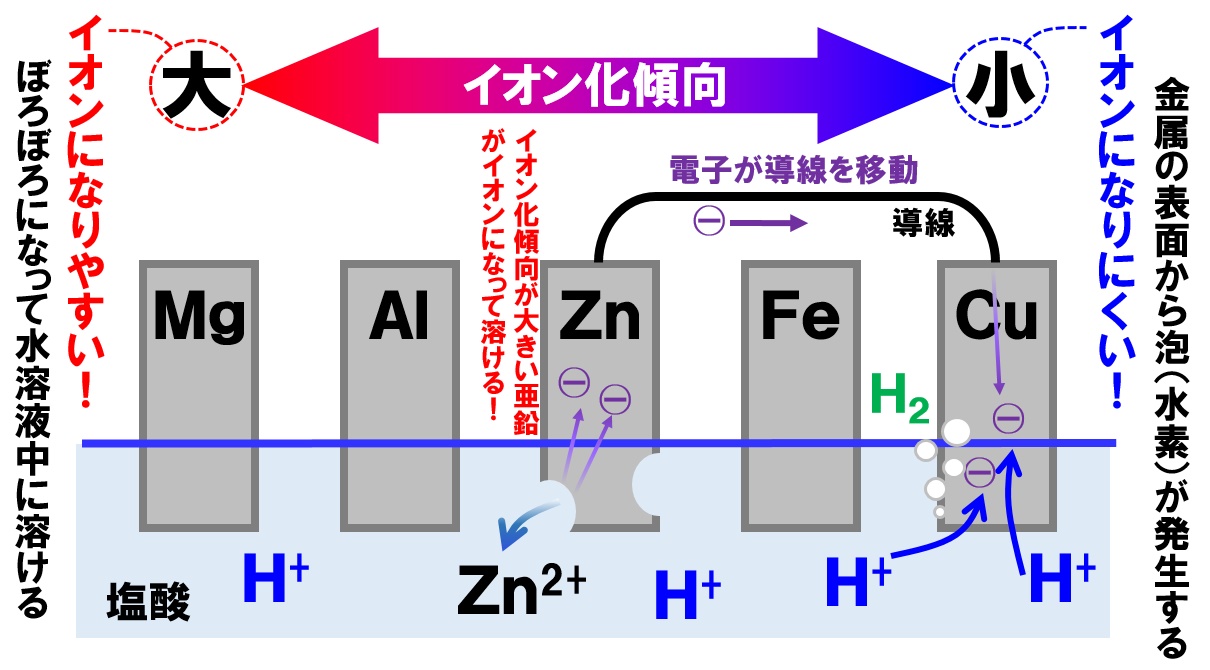
化学電池でよく登場する、うすい塩酸の中に、亜鉛板と銅板をさしこんだ実験で考えていきます。うすい塩酸(電解質水溶液)に亜鉛板と銅板(2種類の金属)をさしこむと、次のような変化が生じます。
- 亜鉛Znが亜鉛イオンZn²⁺になって塩酸中に溶ける。
- このとき、亜鉛Znは電子を2個放出する。
- 電子が導線を通って銅板に移動する。
- 塩酸中の水素イオンH⁺が電子と結びつき、水素原子Hになる。
- 水素原子Hが2個が結びつき水素分子H₂になって発生する。
亜鉛板は塩酸中に溶けるのでぼろぼろになっていき、銅板からは水素H₂(泡)が発生します。
化学電池の極
電子は-極から+極に移動すると電気分野で学習しました。電子は亜鉛板から銅板に移動しているので、亜鉛板が-極、銅板が+極になっています。
電流は、電子が移動する向きと逆向きになることも学習しています。なので、+極の銅板から-極の亜鉛板に電流が流れます。
- 亜鉛板Zn(-極)
電子が出ていく。
電流が流れ込む。 - 銅板Cu(+極)
電子が入ってくる。
電流が出ていく。
イオン化傾向でいうと、「Mg>Al>Zn>Fe>Cu」で、亜鉛板の方が銅板よりもイオン化傾向が大きいです。つまり、イオン化傾向が大きい金属が-極になり、イオン化傾向が小さい金属が+極になるのです。


コメント