中学3年理科。塩化銅水溶液の電気分解について学習します。
- レベル★★★☆
- 重要度★★★★
- ポイント:銅イオンと塩化物イオンの電子のやり取りをマスター!
授業用まとめプリント下記リンクからダウンロード!
授業用まとめプリント「塩化銅の電気分解」
塩化銅水溶液の電気分解の学習方法
塩化銅水溶液は、固体の塩化銅が水に溶けてできる青色の水溶液です。塩化銅水溶液の電気分解をマスターするには、次の2つの流れを押さえることが重要です。まずは、「塩化銅が水に溶けて塩化銅水溶液になる」流れ、次に、「塩化銅水溶液中のイオンが電極で変化する」流れになります。
この2つをしっかりと理解できれば、塩化銅水溶液の学習は完ぺきになります。また、どうしても苦手だという人は、化学反応式が書ける、どの電極で何が発生する、発生した物質の性質は最低限覚えるようにしましょう。
塩化銅の電離
電解質である固体の塩化銅を水に溶かすと、陽イオンと陰イオンに電離します。
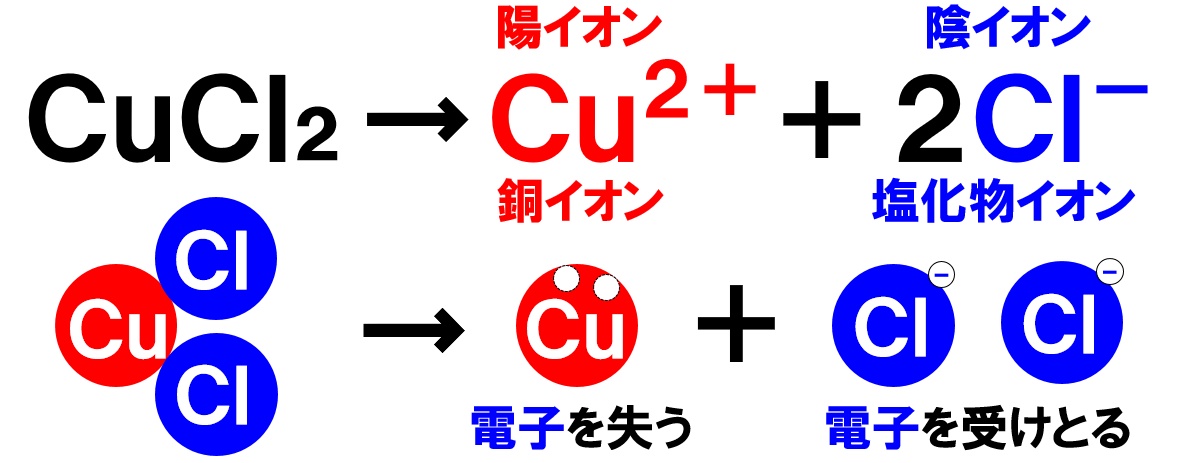
塩化銅の化学式はCuCl₂でした。化学式の前に書いてある銅原子Cuが電子を2個失い2価の陽イオンである銅イオンCu²⁺に、後に書いてある2個の塩素原子Clがそれぞれ電子を1つずつ受けとり、陰イオンである塩化物イオンCl⁻2個に電離します。
このとき、銅イオンCu²⁺1個に対して、塩化物イオンCl⁻は2個生じることも覚えておきましょう。Cu²⁺:Cl⁻=1:2で生じます。
これらのイオンが水溶液中にあるのが塩化銅水溶液です。銅イオンCu²⁺が青色なので、塩化銅水溶液の色は青色になります。
塩化銅水溶液の電気分解
できた塩化銅水溶液に電圧をかけ、電気分解を行います。電源装置の+極とつないだ陽極に引き寄せられるイオンは、-の電気を帯びている塩化物イオンCl⁻です。電源装置の-極につないだ陰極に引き寄せられるイオンは、+の電気を帯びた銅イオンCu²⁺になります。
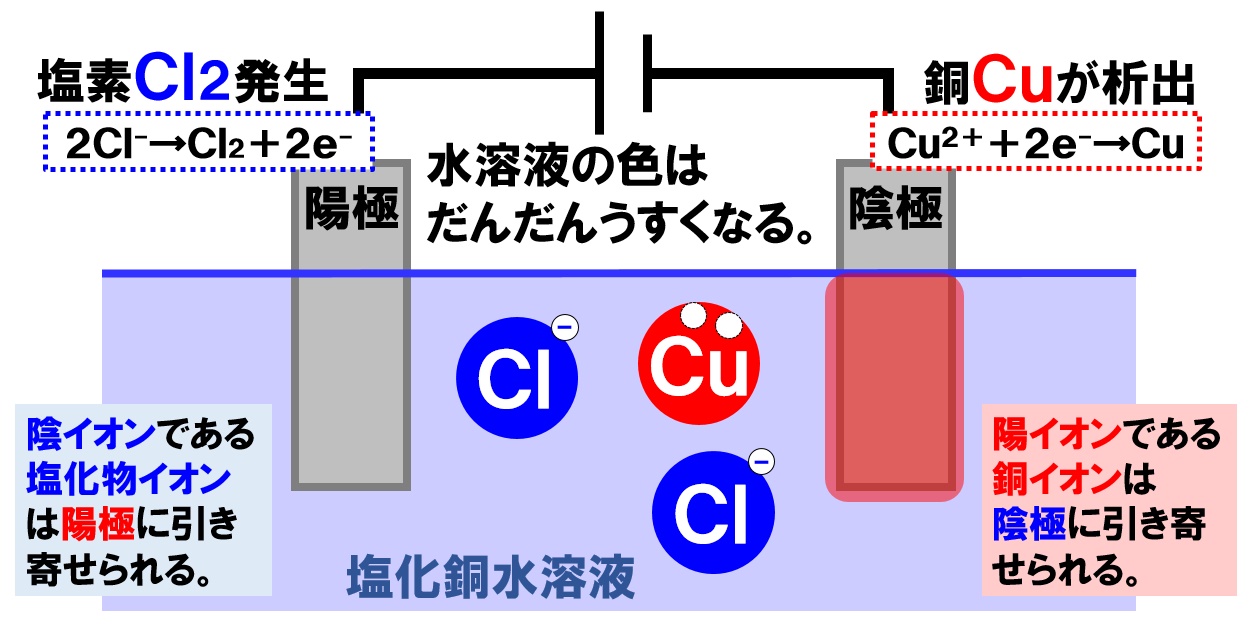
陽極での変化
陽極での変化は、塩酸の電気分解と全く同じになります。陰イオンの塩化物イオンCl⁻が電子を失い塩素Cl₂が発生します。
- 塩化物イオンCl⁻が陽極に引き寄せられる。
- 塩化物イオンCl⁻が陽極に電子をe⁻を渡す。
- 塩化物イオンCl⁻が塩素原子Clに戻る。
- 塩素原子Clが2個くっつき、塩素分子Cl₂になって発生する。
- 陽極の電子e⁻は導線を通って陰極に移動する。
塩化物イオンCl⁻が電子を失って塩素原子Clに戻っていることがポイントです。また、陽極から塩素Cl₂が発生していることもしっかりと覚えておきましょう。
陰極での変化
陰極には陽イオンである銅イオンCu²⁺が引き寄せられ、電子を受けとり銅原子に戻る反応が起こります。
- 銅イオンCu²⁺が陰極に引き寄せられる。
- 導線を通って電子e⁻が陰極にやってくる。
- 銅イオンCu²⁺が電子e⁻を2個受け取り、銅原子Cuに戻る。
- 陰極の表面に赤褐色の銅Cuが析出する。
銅イオンCu²⁺が電子を2個受け取って銅原子Cuに戻ることがポイントです。また、析出する銅の色は赤褐色で、水溶液中の銅イオンCu²⁺が減少するので、青色が薄くなっていくことも覚えておいて下さい。
塩化銅水溶液の電気分解の化学反応式
塩化銅水溶液を電気分解すると、陰極には銅Cuが析出し、陽極からは塩素Cl₂が発生することがわかりました。これを化学反応式で書き表すと次のようになります。
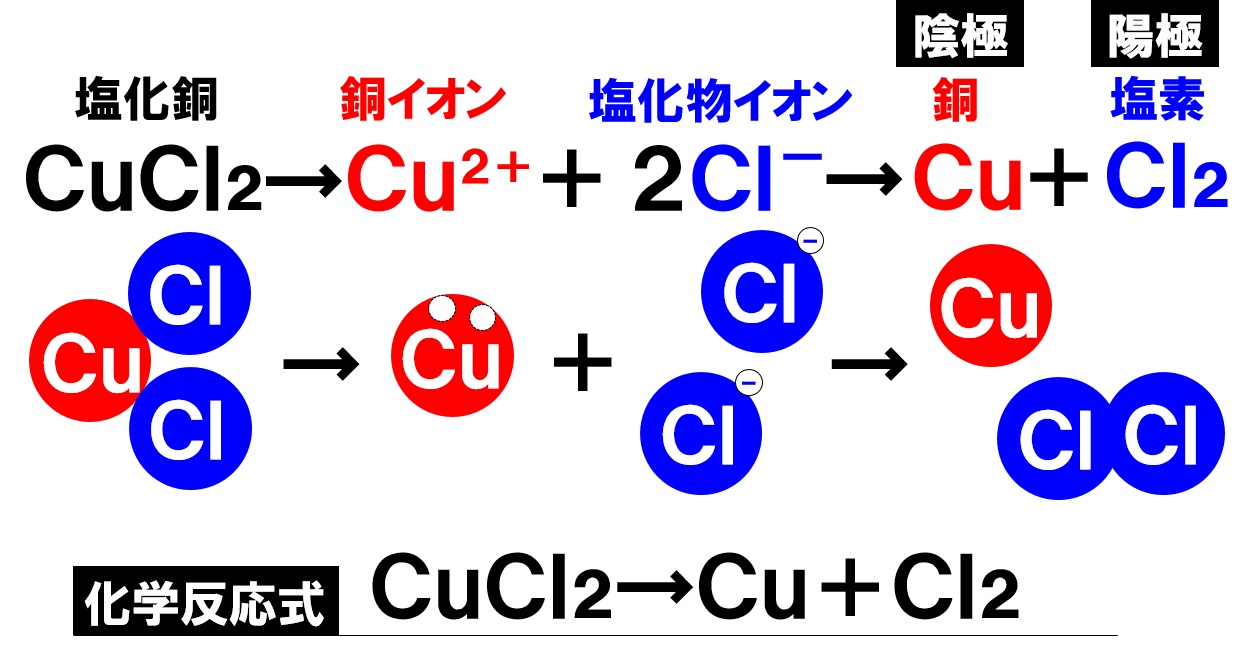
化学変化前の塩化銅CuCl₂を左辺に、化学変化後にできる物質である銅Cuと塩素Cl₂を右辺に書きます。この状態で、左辺と右辺の原子の個数が一致しているので、係数は必要ありません。
塩化銅水溶液の電気分解で発生する物質の性質
陽極から発生する塩素Cl₂は、塩酸の電気分解で説明しましたが、もう一度復習しておきましょう。陰極から発生する銅は金属の性質を持っています。
- 銅Cu…赤褐色の金属。
・みがくと金属光沢が出る。
・たたくとうすく広がり(展性)、ひっぱると伸びる(延性)。
・熱や電気をよく通す。 - 塩素Cl₂…水によく溶ける気体で黄緑色。
赤インクをしみ込ませたろ紙を近づけると、色が抜けて白くなる(脱色作用)。
今回は特に色に注意しましょう。塩化銅水溶液の色は青色で、析出する銅は赤色、発生する塩素は黄緑色になります。

コメント