中学校で学習する酸とアルカリについて学習します。
- レベル★★☆☆
- 重要度★★★☆
- ポイント:水素イオンと水酸化物イオンに注目!
授業用まとめプリントは下記リンクよりダウンロード!
授業用まとめプリント「酸とアルカリ」
酸とアルカリ
小学校で、酸性の水溶液・アルカリ性の水溶液について学習しました。塩酸や炭酸水、お酢など、すっぱい水溶液が酸性で、青色リトマス紙の色を赤色に変化させましたね。一方、水酸化ナトリウム水溶液やアンモニア水、石灰水などは、赤色リトマス紙を青色に変える性質があるアルカリ性の水溶液でした。
今日は、この酸性やアルカリ性の正体について学習します。水溶液中に何イオンがあるときに酸性やアルカリ性になるのか。また、水に溶けて酸性になる物質を酸、水に溶けてアルカリ性になる物質をアルカリということも学習しています。
- 酸性→青色リトマス紙を赤色に変える。
- アルカリ性→赤色リトマス紙を青色に変える。
酸
酸とは、水に溶けたり液体になったりして電離すると、水素イオンH⁺が生じ、酸性を示す物質です。代表的な酸は塩化水素や二酸化炭素などです。塩化水素や二酸化炭素は、水に溶けると電離し、水素イオンH⁺が生じます。このH⁺が水溶液中にあれば酸性になるのです。
例えば、あなたがお風呂に入って、入った後のお風呂の水を調べると酸性になっていた場合、あなたは酸ということになります。このとき、お風呂の水の中には水素イオンH⁺があるはずです。
アルカリ
アルカリとは、水に溶けたり液体になったりして電離すると、水酸化物イオンOH⁻が生じ、アルカリ性を示す物質です。代表的なアルカリは、水酸化ナトリウムや水酸化バリウム、アンモニア、石灰などです。これらは電離すると必ず水酸化物イオンOH⁻が生じアルカリ性を示します。
例えば、あなたがお風呂に入って、入った後のお風呂の水を調べるとアルカリ性になっていた場合、あなたはアルカリということになります。このとき、お風呂の水の中には水酸化物イオンOH⁻があるはずです。
酸の電離
次は、重要な酸の電離について具体的に見ていきましょう。電離のようすを表す式が書ける状態になっておきましょう。
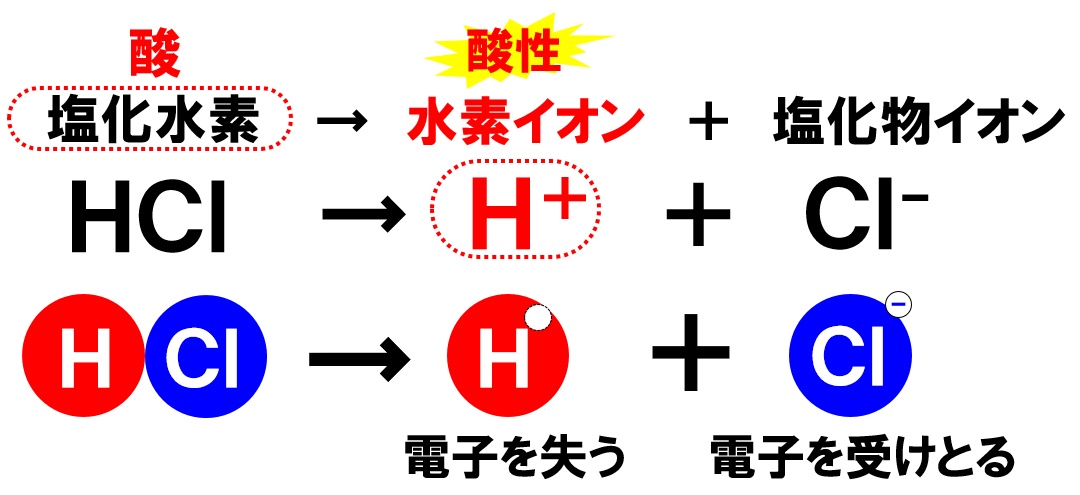
塩酸の電離
塩酸は、気体の塩化水素が水に溶けてできる酸性の水溶液です。電離のようすは次の通りです。
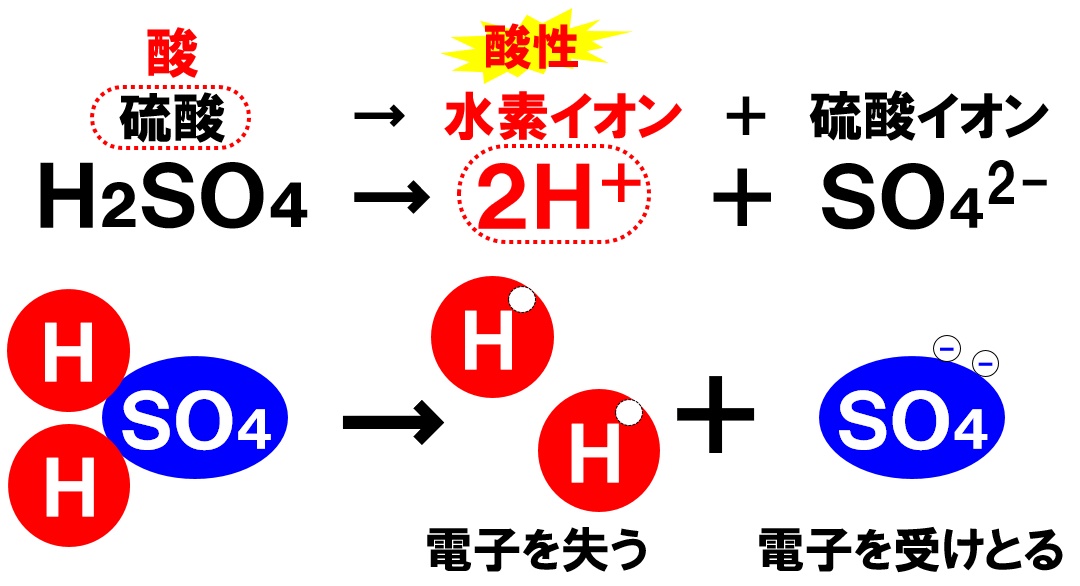
硫酸の電離
硫酸は、液体の濃硫酸を水で薄めたものになります。電離のようすは次の通りです。
アルカリの電離
アルカリについても、代表的なアルカリの電離のようすを表す式を書けるようになっておきましょう。
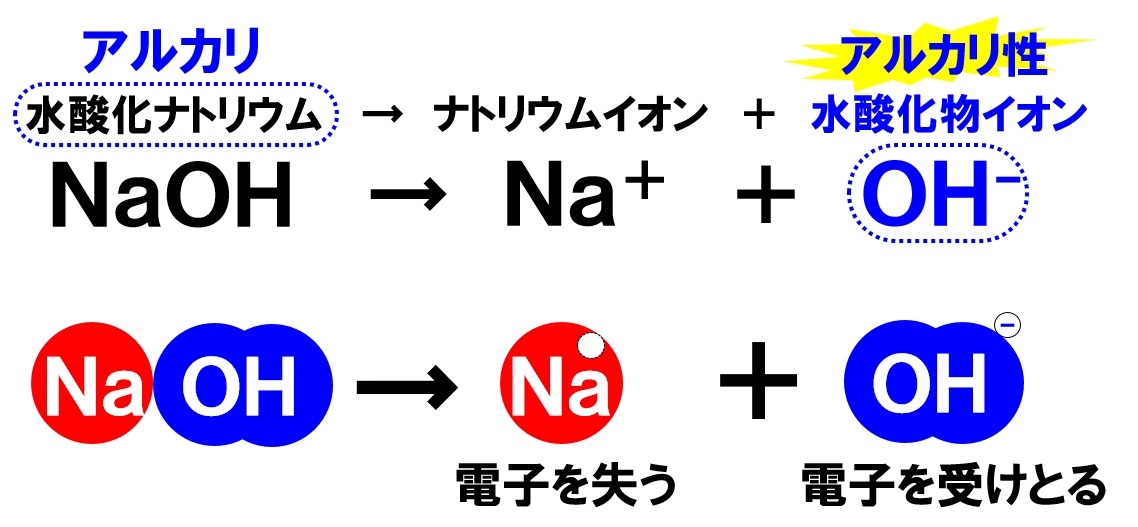
水酸化ナトリウムの電離
水酸化ナトリウム水溶液には、固体の水酸化ナトリウムが溶けています。電離のようすは次の通りです。
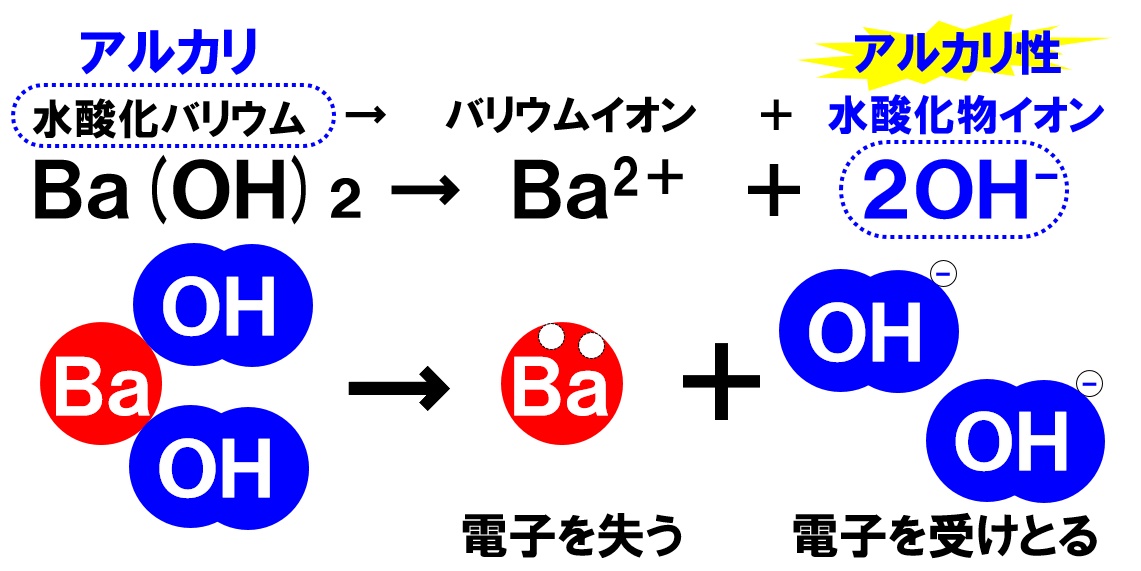
水酸化バリウムの電離
水酸化バリウム水溶液には、固体の水酸化バリウムが溶けています。電離のようすは次の通りです。


コメント