中学3年理科。イオンと化学変化で登場するイオン化傾向を学習します。
- レベル★★★☆
- 重要度★★☆☆
- ポイント:マグアルアエンテツドウ!
授業用まとめプリントは下記リンクよりダウンロードしてください!
授業用まとめプリント「イオン化傾向」
イオン化傾向
イオン化傾向とは、金属のイオンへの成りやすさを表したものです。イオン化傾向が大きい金属ほどイオンになりやすく、イオン化傾向の小さな金属ほどイオンになりにくいことを表しています。
金属がイオンになるということはどういうことかというと、金属が水溶液中に溶けたり、さびたりするということです。つまり、イオン化傾向が大きい金属ほど反応しやすく、すぐにぼろぼろになったりする金属になります。
イオン化傾向では、次の金属を覚えます。左側の金属ほどイオンになりやすく、右側に行くにつれてイオンになりにくくなっています。

右側に行くほど、高価な金属が並んでいますね。右側ほどイオン化傾向が小さく、反応しにくい金属なので、さびにくくいつまでも輝き続ける金属です。
また、途中に金属ではない水素(H)があえますが、この水素(H)より左側の金属は水素よりもイオンになりやすい金属で、水素イオンH⁺が溶けている水溶液に、これらの金属を入れると金属がイオンになり、水素イオンが水素原子に戻ります。その後水素原子は2個くっついて、水素分子H₂になって発生します。
つまり、うすい塩酸などに金属を入れた場合、水素(H)より左側の金属からは水素が発生しますが、水素(H)より右側の金属は反応しないことがわかります。
※ただし一部例外もあります。それは高校の化学で学習します。
イオン化傾向の覚え方
イオン化傾向では多くの金属が登場し覚えるのが大変ですので、語呂合わせを使って簡単に覚えてしまいましょう。いろいろな語呂がありますが、私はこれで覚えています。

マグアルアエンテツドウ
イオン化傾向ですが、実は中学生でここまで覚えてもあまり意味がありません。知ってて損は全くないのですが、こんなに覚えきれないという人のために、最低限の金属のイオン化傾向を覚える方法を伝授します。下の金属を覚えましょう。
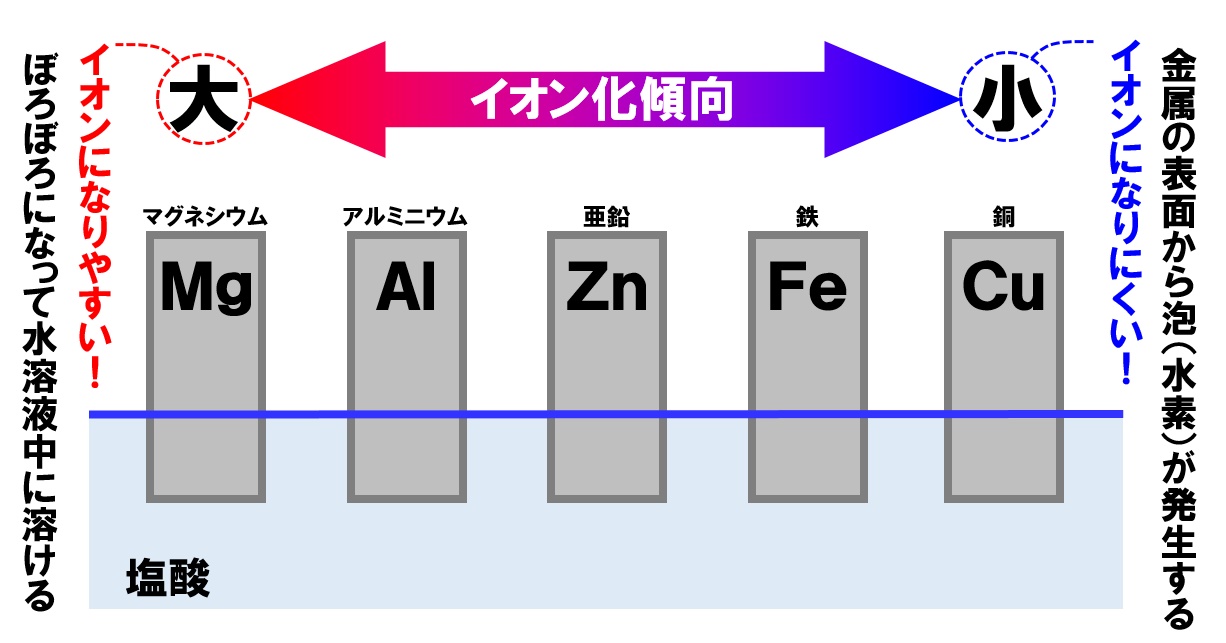
左側の金属ほどイオン化傾向が大きい金属、右側ほどイオン化傾向が小さな金属になります。覚え方は、
「マグアルアエンテツドウ!」
です。ここまで覚えておけば、次の回で学習する化学電池のしくみも完璧に理解できます。
化学電池のしくみ
化学変化を利用して、化学エネルギーを電気エネルギーに変換する装置を「化学電池」といいます。詳しくは次に学習しますが。ここでは、イオン化傾向と化学電池がどうかかわっているのかを簡単に説明します。
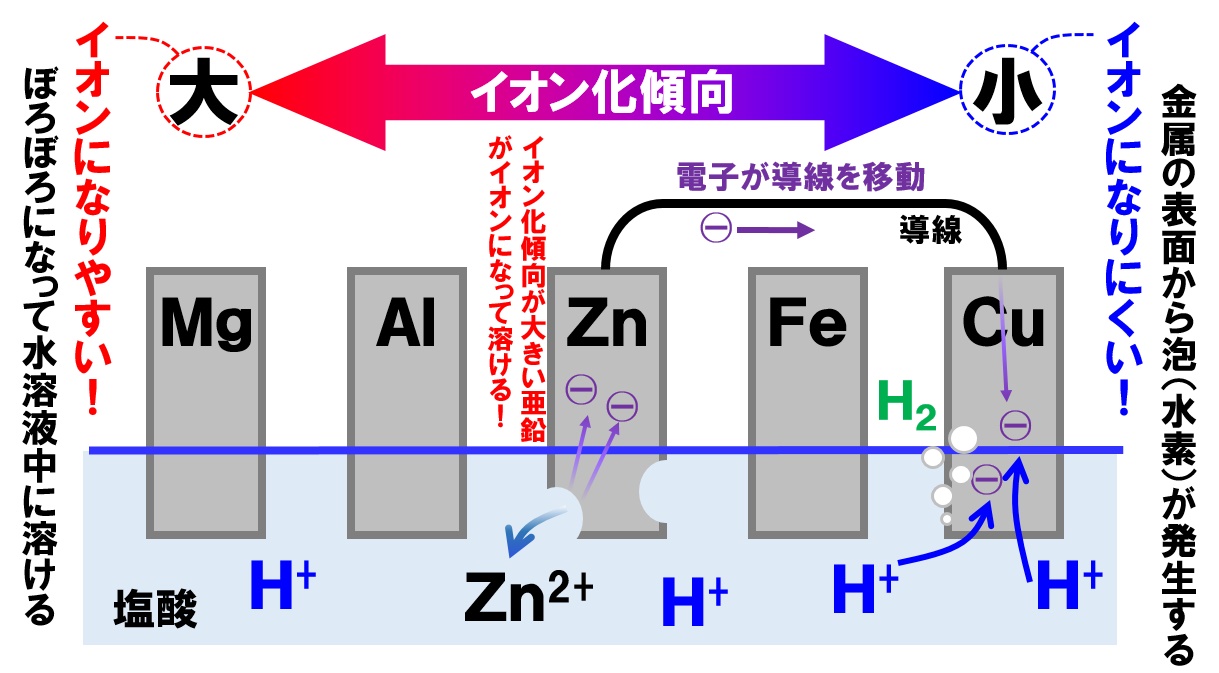
イオン化傾向の異なる金属を、うすい塩酸などの電解質が溶けた水溶液に入れます。そうすると、金属板で電子のやり取りが発生します。
- イオン化傾向が大きな金属が溶けてイオンになる。
- 金属がイオンになったときに放出された電子が、導線を通ってもう一方の金属板に移動する。
- 電解質水溶液中の水素イオンが電子を受けとり水素が発生する。
という流れです。

コメント
[…] 図はこちらからお借りしました→https://pikuumedia.com/rika3-28/ […]