中学3年理科。イオンと化学変化で登場する燃料電池について学習します。
- レベル★☆☆☆
- 重要度★★☆☆
- ポイント:燃料電池は水の電気分解の逆反応!
授業用まとめプリントは下記リンクよりダウンロード!
授業用まとめプリント「燃料電池」
燃料電池
燃料電池とは、化学変化で化学エネルギーを電気エネルギーに変換する装置で、基本的には化学電池としくみは同じです。
化学電池と異なる点は、使う物質が違うということです。化学電池では、2種類の異なる金属と電解質水溶液を使って電気エネルギーをとり出しましたが、燃料電池では水素と酸素を使います。
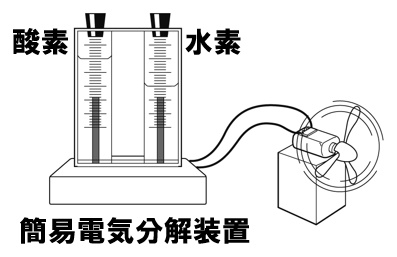
水素と酸素を反応させると、水が生じました。空気中で水素に火をつけたときと同じ反応です。このときに電気エネルギーが取り出せるのです。
【燃料電池】 水素+酸素→水+電気エネルギー
燃料電池の利点は、電気エネルギーを取り出した後に水しか残らないことです。非常にクリーンなエネルギーですよね。燃料電池車などが現在開発されていますが、実用化にはもう一歩という段階です。
水の電気分解と燃料電池
燃料電池で起こっている反応は、実は水の電気分解とは全く逆の反応になっています。
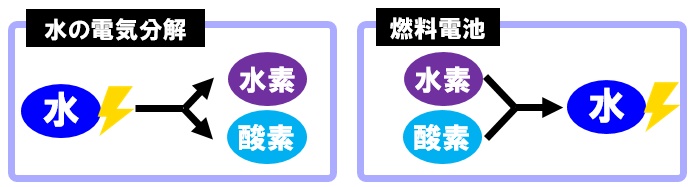
【水の電気分解】
水+電気エネルギー→水素+酸素
2H₂O→2H₂+O₂
【燃料電池】
水素+酸素→水+電気エネルギー
2H₂+O₂→2H₂O
化学反応式を見てもらうと一目瞭然です。矢印が逆になっているだけだとわかります。実際の入試問題などでは、水の電気分解を行った後、できた水素と酸素で燃料電池にするという問題が多いようです。
授業用まとめプリントは下記リンクよりダウンロード!
授業用まとめプリント「燃料電池」

コメント