中学1年理科。溶解度のグラフと再結晶について学習します。
- レベル★★☆☆
- 重要度★★★☆
- ポイント:温度による溶解度の違い
授業用まとめプリントは下記リンクからダウンロード!
授業用まとめプリント「溶解度のグラフ」
溶解度
溶解度とは、水100gに溶ける物質の最大量のことです。溶解度は、物質の種類によって大きく異なります。また、温度が変化すると溶解度も大きく変わります。固体の場合、温度が高くなると、溶解度が大きくなります。逆に温度が下がると溶解度は小さくなります。
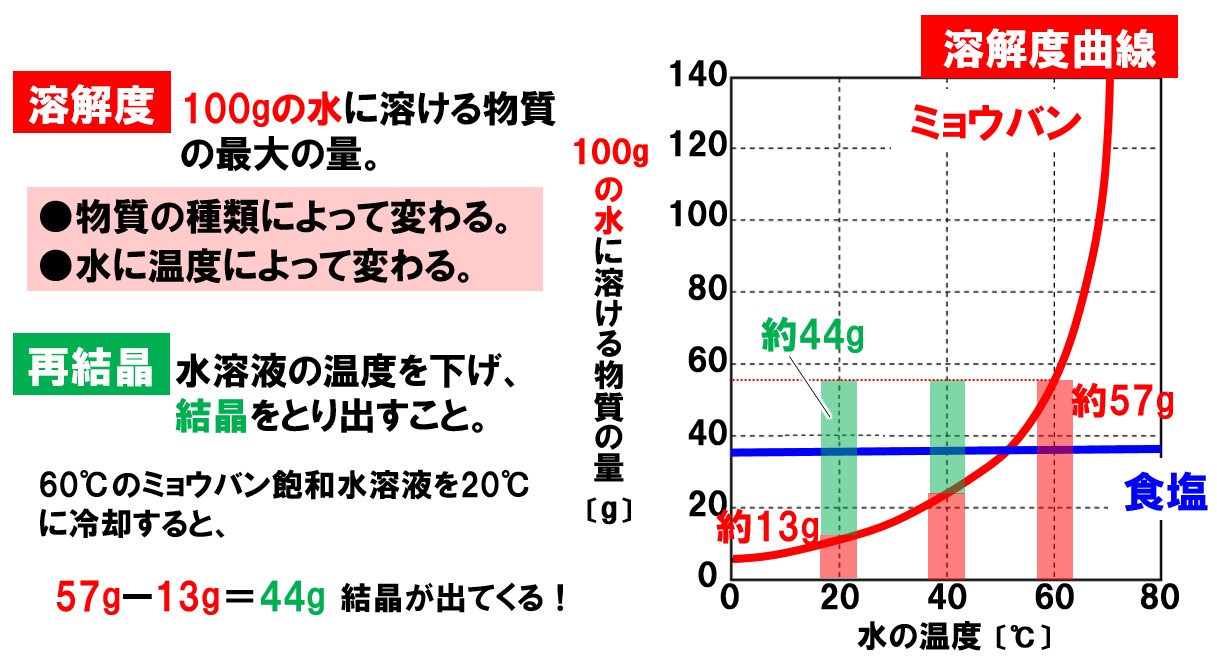
また、溶解度まで物質を溶かした水溶液を飽和水溶液といいます。つまり、もうこれ以上溶けないところまで物質が溶けいる水溶液です。
(1)水100gに物質が溶ける最大の量を何というか。
(2)物質が水に溶ける量いっぱいまで溶けた水溶液を何というか。
(2)物質が水に溶ける量いっぱいまで溶けた水溶液を何というか。
解答(1)溶解度 (2)飽和水溶液
再結晶
物質の温度による溶解度の違いを利用して、水溶液から固体を取り出す方法があります。高温の水に物質を溶かし、水溶液の温度を下げることで結晶をとり出す操作を再結晶といいます。
温度により、溶解度が大きく変化する物質を取り出すことができます。計算問題も出題されるので、グラフの見方と計算方法をマスターしましょう。
再結晶の計算
下のグラフは、水100gに溶ける硝酸カリウムの量を示したグラフである。
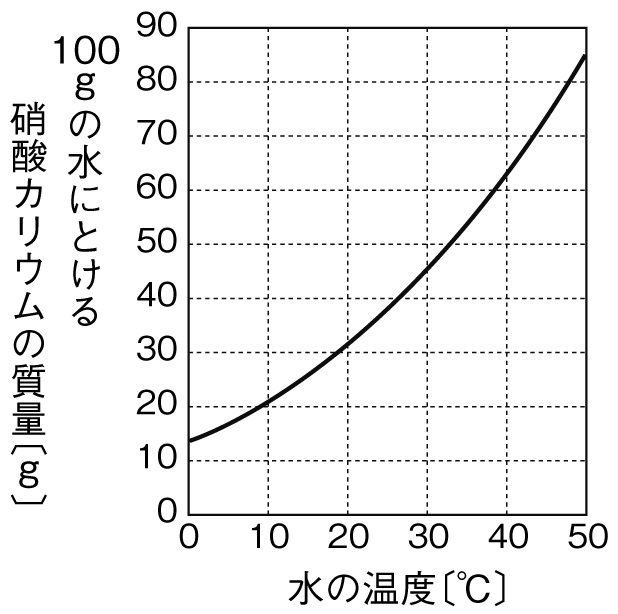
40℃の水100gに硝酸カリウムを溶けるだけ溶かし、水溶液の温度を10℃まで下げると、出てくる結晶の量は何gか。ただし、40℃の硝酸カリウムの溶解度を64g、10℃の硝酸カリウムの溶解度を21gとする。
下のグラフは、水100gに溶ける硝酸カリウムの量を示したグラフである。

40℃の水100gに硝酸カリウムを溶けるだけ溶かし、水溶液の温度を10℃まで下げると、出てくる結晶の量は何gか。ただし、40℃の硝酸カリウムの溶解度を64g、10℃の硝酸カリウムの溶解度を21gとする。
解答43g 64g-21g=43g
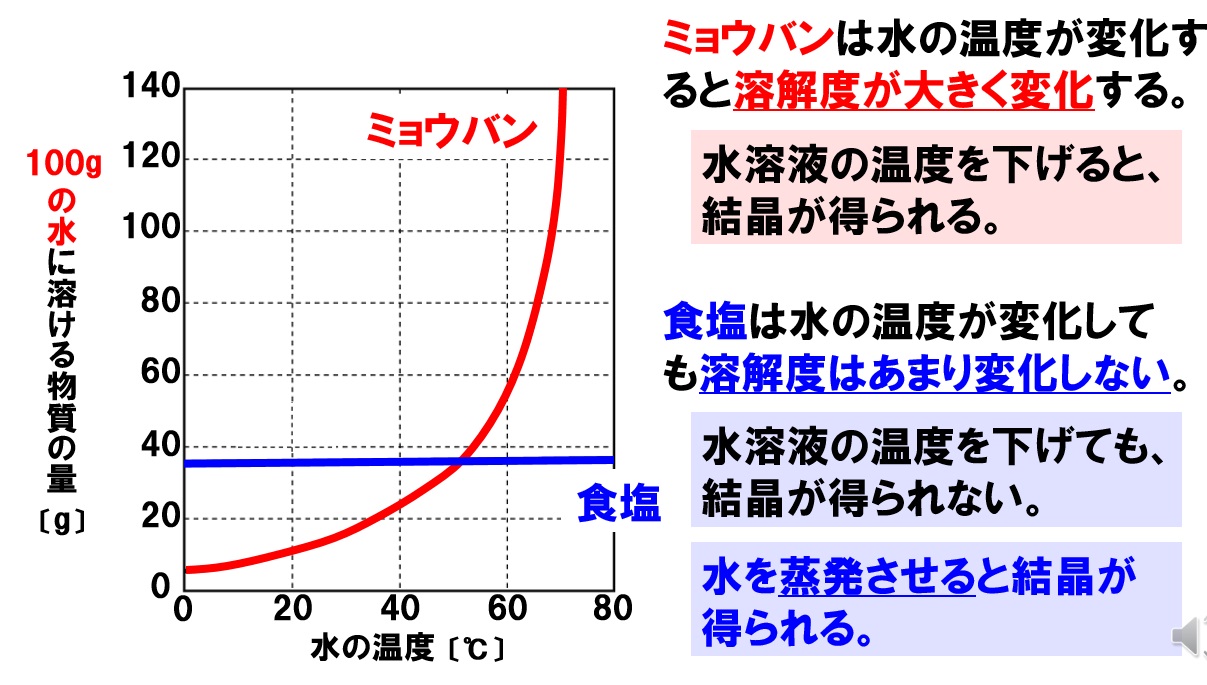
溶解度の記述問題
溶解度では、ミョウバンや硫酸銅などの物質と、食塩の溶解度の違いを聞いてくる問題が、記述問題で出題されます。

コメント