中学2年理科。化学変化と質量の計算問題について見ていきます。
- レベル★★★☆
- 重要度★★★☆
- ポイント:比例式の計算をマスター
化学変化と質量
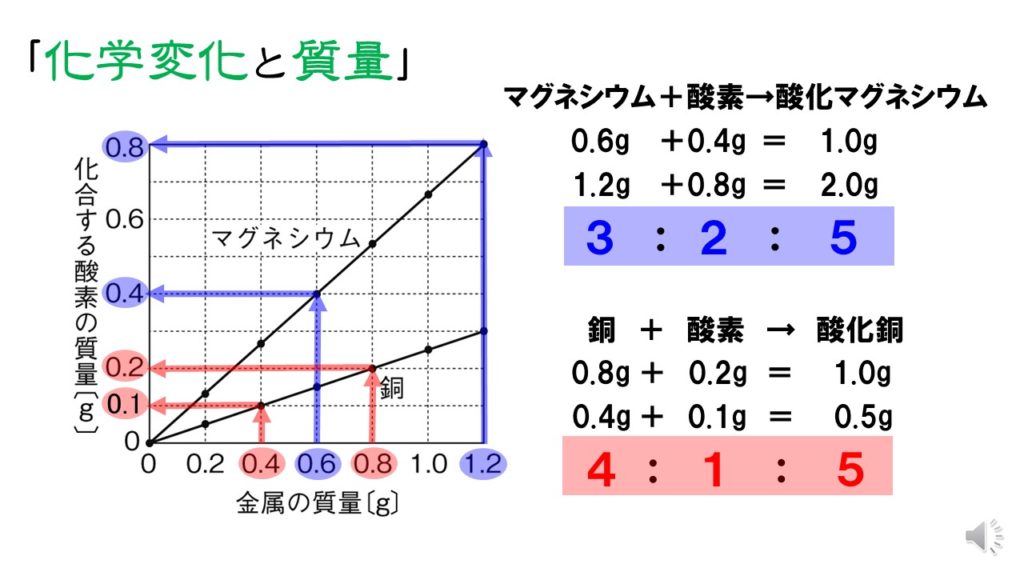
化学変化にともなって物質の質量がどのように変化するのか確認しましょう。銅粉を空気中で加熱すると、空気中の酸素が化合して酸化銅ができます。
銅+酸素→酸化銅
このときの質量の関係は、
- 銅0.4gに酸素0.1g
- 銅0.8gに酸素0.2g
- 銅1.2gに酸素0.3g
と、加熱する銅の質量が変わっても、一定の割合で酸素が化合しています。つまり、化学変化に伴う物質の質量の比は一定になるのです。上記の銅と酸素の質量を簡単な整数比で表すと、
銅:酸素=4:1
になります。化学変化では、常に一定の割合で物質が反応しますので、この関係を使って反応する物質やできる物質を計算できることになります。
覚えておく質量比
グラフや表などのヒントが問題文中に登場しますので、絶対に覚える必要はありませんが、物質による必量の比は決まっているので、次の比を覚えておくと計算が速くなります。
- 銅:酸素:酸化銅=4:1:5
- マグネシウム:酸素:酸化マグネシウム=3:2:5
- 鉄:硫黄:硫化鉄=7:4:11
化学変化と質量の計算方法
化学変化と質量に関する計算問題では、次の手順で計算します。
- 登場する物質を確認する。
- 完全に反応しているか、不完全な反応・過不足が生じないか確認。
- 完全に反応している場合は、質量比を使って比例式をたてる。
- 比例式を問いて答えを求める。
以上が計算方法です。不完全な反応や・過不足が生じる場合は例題で確認します。まずは、過不足なく完全に物質が反応する場合を見ていきましょう。
銅やマグネシウムの酸化の計算
質量0.4gの銅粉を空気中で加熱し、完全に反応させると、酸化銅が0.5g生じた。3.6gの銅粉を加熱し完全に反応させると、何gの酸化銅が生じるか。
解答4.5g
銅の質量から酸化銅の質量を求めます。
過不足なく完全に反応しているので、質量比を使って比例式をたてます。
4:5=3.6:x
x=4.5
1.2gマグネシウムリボンを空気中でガスバーナーを使って加熱し、酸素と十分に反応させたところ、2.0gの酸化マグネシウムが生じた。0.6gのマグネシウムリボンを空気中で完全に酸素と反応させると、何gの酸素が化合するか。
解答0.4g
マグネシウムの質量から化合した酸素の質量を求めます。
過不足なく反応しているので、質量比を使って比例式をたてます。
マグネシウムと酸素の質量比は、3:2なので、
3:2=0.6:x
x=0.4
酸化が不十分な場合
酸化が不十分な場合の計算は次のように計算します。
- 質量の増加分から化合した酸素の質量を求める。
- 酸素と銅の質量比を使って、反応した銅の質量を求める。
- 加熱前の全体の質量から反応した銅の質量を引き、未反応の銅の質量を求める。
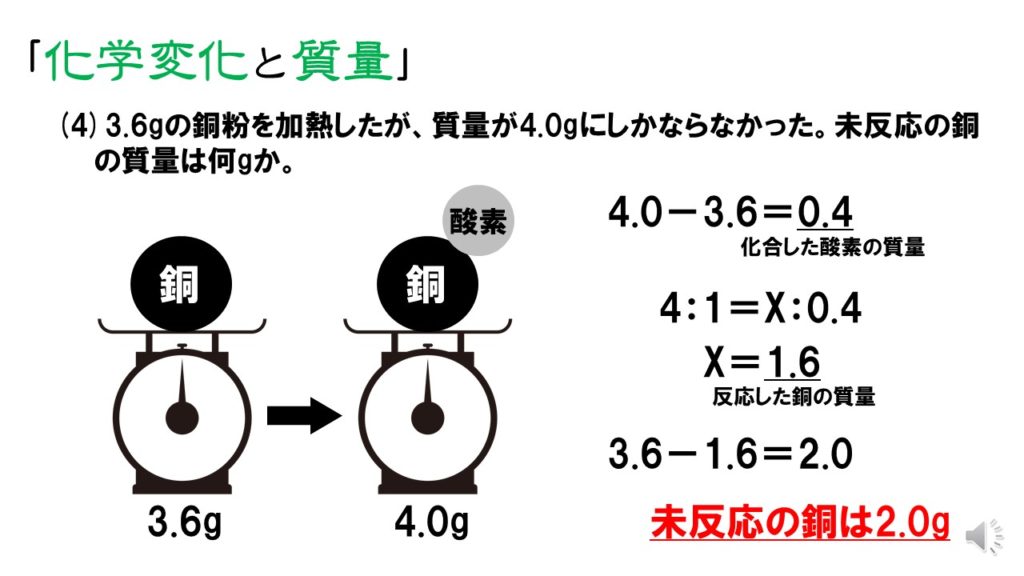
不完全な酸化
3.0gマグネシウムをステンレス皿の上で加熱したが、反応が不十分で、加熱後の質量は4.4gになった。未反応のマグネシウムの質量を求めよ。ただし、マグネシウムと酸素は質量比3:2で反応するものとする。
解答0.9g
質量の増加分から化合した酸素の質量を求めます。
4.4-3.0=1.4
マグネシウムと酸素の質量比を使って、反応したマグネシウムの質量を求めます。
3:2=x:1.4
x=2.1
加熱前の全体の質量から反応したマグネシウムの質量を引き、未反応のマグネシウムの質量を求めます。
3.0-2.1=0.9

コメント