中学3年理科。中和について学習します。
- レベル:★★★☆
- 重要度:★★★☆
- ポイント:H⁺、OH⁻、Na⁺、Cl⁻の数の変化
授業用まとめプリントは下記リンクよりダウンロード!
授業用まとめプリント「中和と塩」
授業用まとめプリント「中和とイオン数」
中和
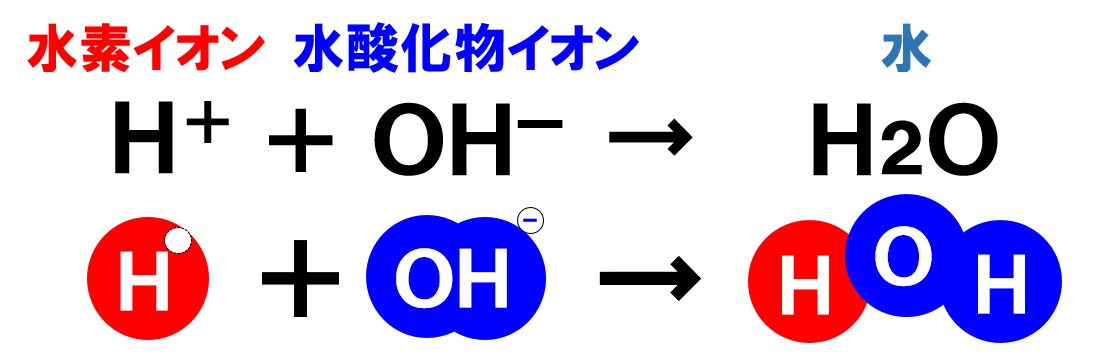
中和とは、酸とアルカリの水溶液を混ぜると、お互いの性質を打ち消し合い、塩と水ができる反応のことをいいます。酸の水溶液には必ず水素イオンH⁺があります。アルカリの水溶液には水酸化物イオンOH⁻があります。中和では、水素イオンH⁺と水酸化物イオンOH⁻が打ち消し合い、水H₂Oができる反応が起こっているのです。
塩(えん)
中和では、水素イオンH⁺と水酸化物イオンOH⁻が反応して水H₂Oが生じますが、水以外にもう一つ物質が生じます。中和によってできる水以外の物質を塩といいます。
酸の陽イオンは水素イオンH⁺、アルカリの陰イオンは水酸化物イオンOH⁻ですので、酸の陰イオンとアルカリの陽イオンが反応して塩ができるということになります。生じる塩は、酸とアルカリの種類によって様々です。塩の性質もきかれますので、そこも覚えていきましょう。
塩酸と水酸化ナトリウム水溶液の中和
気体の塩化水素が水に溶けた水溶液を塩酸といいました。酸性を示します。この塩酸にアルカリ性の水酸化ナトリウム水溶液を混ぜ中和します。
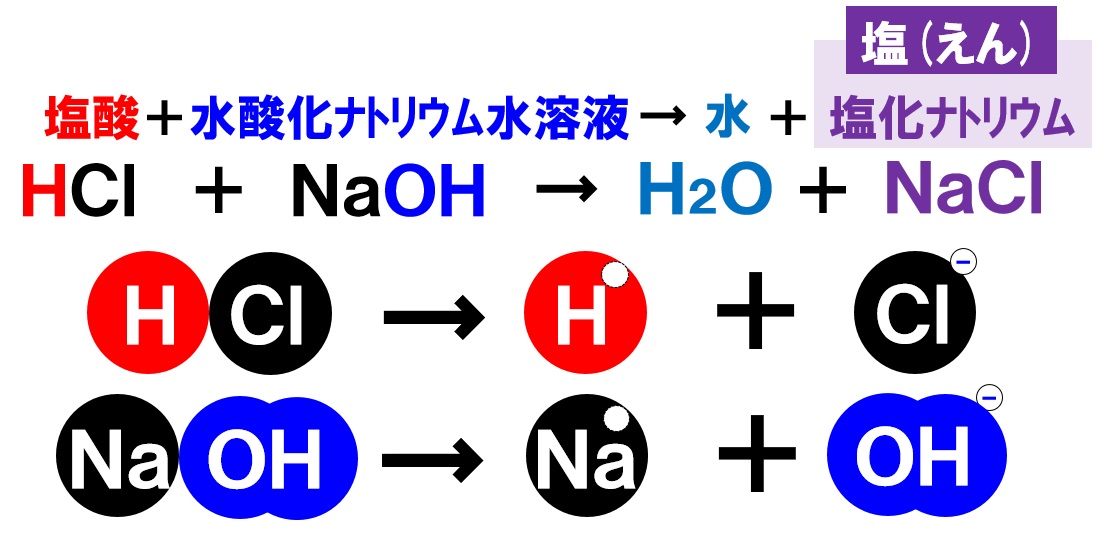
塩酸の中の水素イオンH⁺と水酸化ナトリウム水溶液の中のOH⁻が反応し水H₂Oが生じます。また、塩酸の中の陰イオンである塩化物イオンCl⁻と、水酸化ナトリウム水溶液中の陽イオンであるナトリウムイオンNa⁺が反応し、塩化ナトリウム(食塩)NaClという塩が生じます。
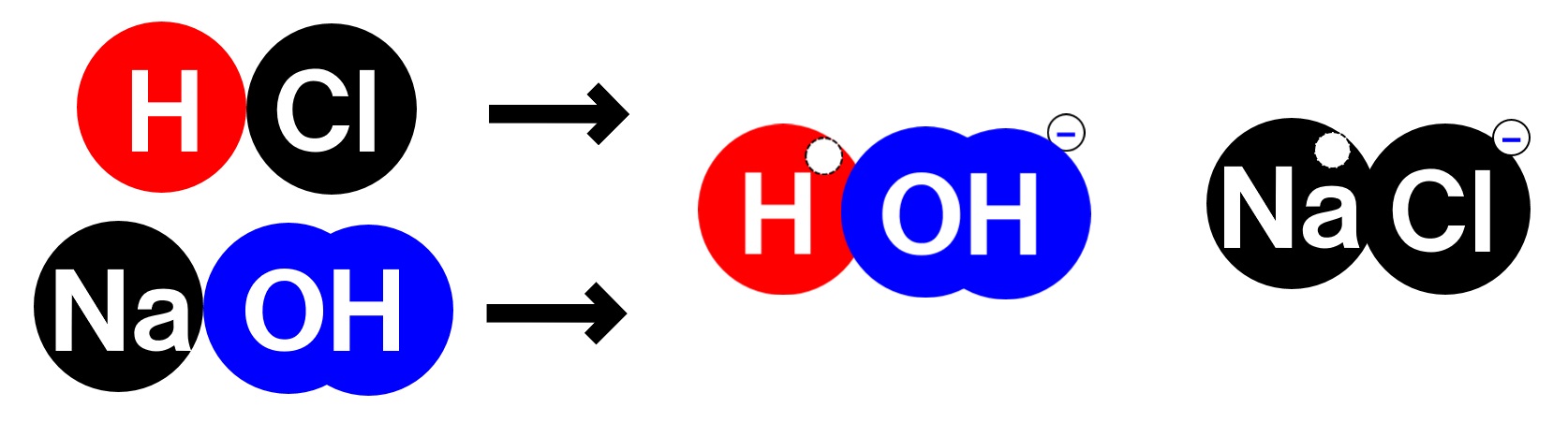
塩化ナトリウム(食塩)は、水に溶けやすい塩ですので、中和後の水溶液中にナトリウムイオンNa⁺、塩化物イオンCl⁻として存在します。
硫酸と水酸化バリウム水溶液の中和
酸性の水溶液である硫酸H₂SO₄と、アルカリ性の水溶液である水酸化バリウム水溶液Ba(OH)₂の中和反応も見ていきましょう。
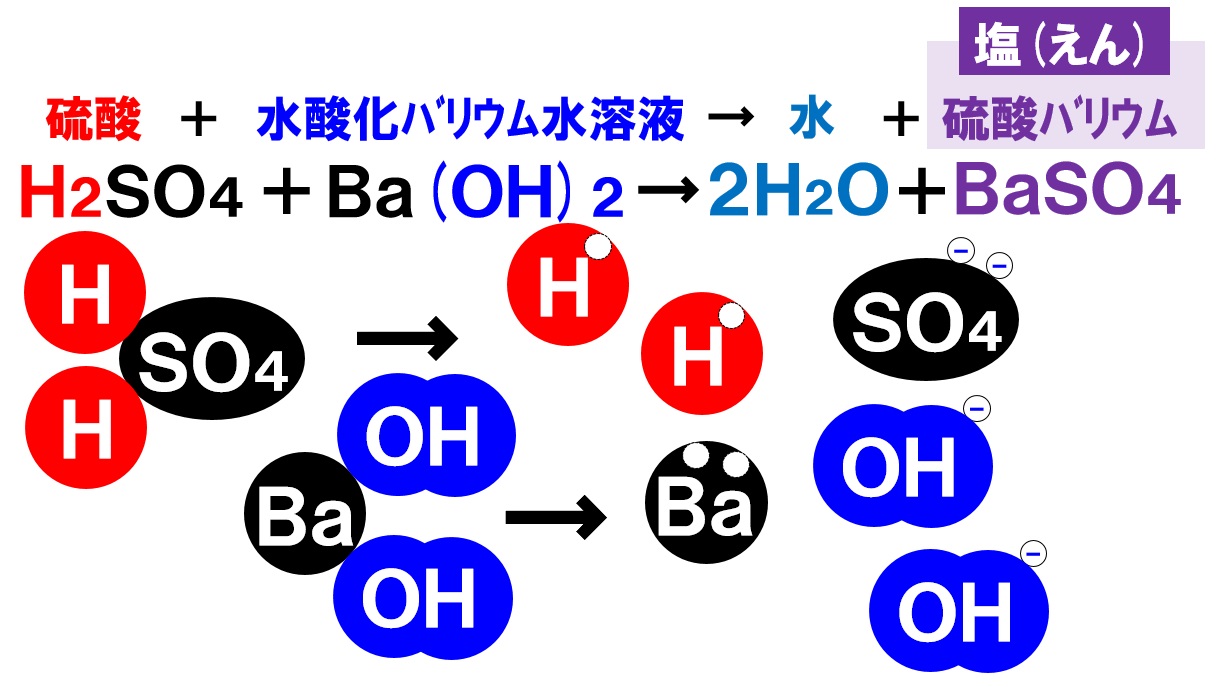
硫酸の中の水素イオンH⁺と水酸化バリウム水溶液の中のOH⁻が反応し水H₂Oが生じます。また、硫酸の中の陰イオンである硫酸イオンSO₄²⁻と、水酸化バリウム水溶液中の陽イオンであるバリウムイオンBa²⁺が反応し、硫酸バリウムBaSO₄という塩が生じます。
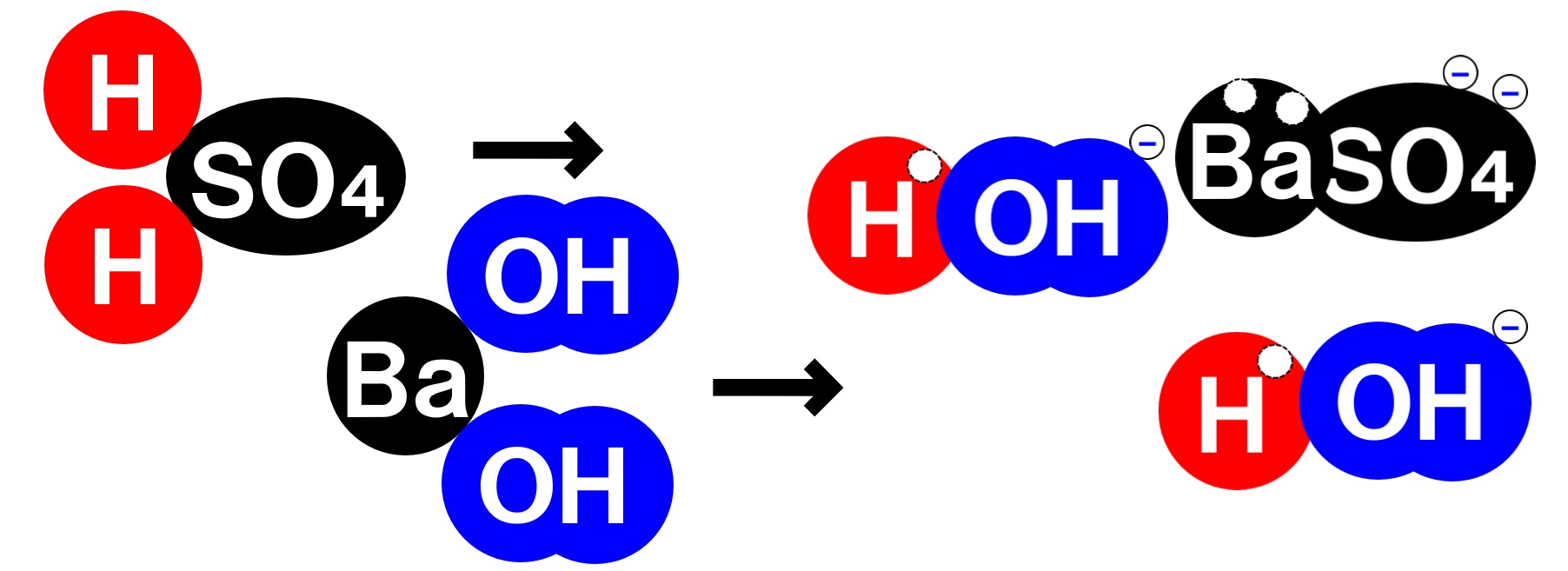
硫酸バリウムは水に溶けにくい塩ですので、水溶液は白くにごり、やがて沈殿します。つまり、硫酸と水酸化バリウム水溶液を完全に中和すれば、水溶液中にイオンがまったく存在しない状態になり電流が流れなくなります。
具体的な中和反応は、以上の塩酸と水酸化ナトリウム水溶液、硫酸と水酸化バリウム水溶液の2つを覚えておけば大丈夫です。
中和とイオンの数
酸の水溶液とアルカリの水溶液を混ぜると、お互いの性質を打ち消し合う、中和反応が起こります。このとき、酸の水素イオンH⁺とアルカリの水酸化物イオンOH⁻が打ち消し合って水H₂Oができ、水の他に塩(えん)ができました
今回は、中和反応が起こっているとき、各イオンの数がどのように変化しているのかを学習します。グラフを書かせる問題も出題されるので、グラフの見方もマスターしましょう。
塩酸の中に水酸化ナトリウム水溶液を入れる場合
塩酸は、塩化水素HClが水に溶けたものでした。HClが電離して水素イオンH⁺と塩化物イオンCl⁻が生じています。この中に、水酸化ナトリウムNaOHを水に溶かした、水酸化ナトリウム水溶液を入れていきます。水酸化ナトリウム水溶液の中には、ナトリウムイオンNa⁺と水酸化物イオンOH⁻が入っています。
水酸化ナトリウム水溶液を塩酸に入れていくと、各イオンの数は次のように変化していきます。
- 水素イオンH⁺
OH⁻と反応して減少する。 - 水酸化物イオンOH⁻
H⁺と反応ししてH₂Oになるので増加しない。
H⁺が無くなると増加していく。 - 塩化物イオンCl⁻
一定量のまま変化しない。 - ナトリウムイオンNa⁺
水酸化ナトリウム水溶液を入れるだけ増加していく。
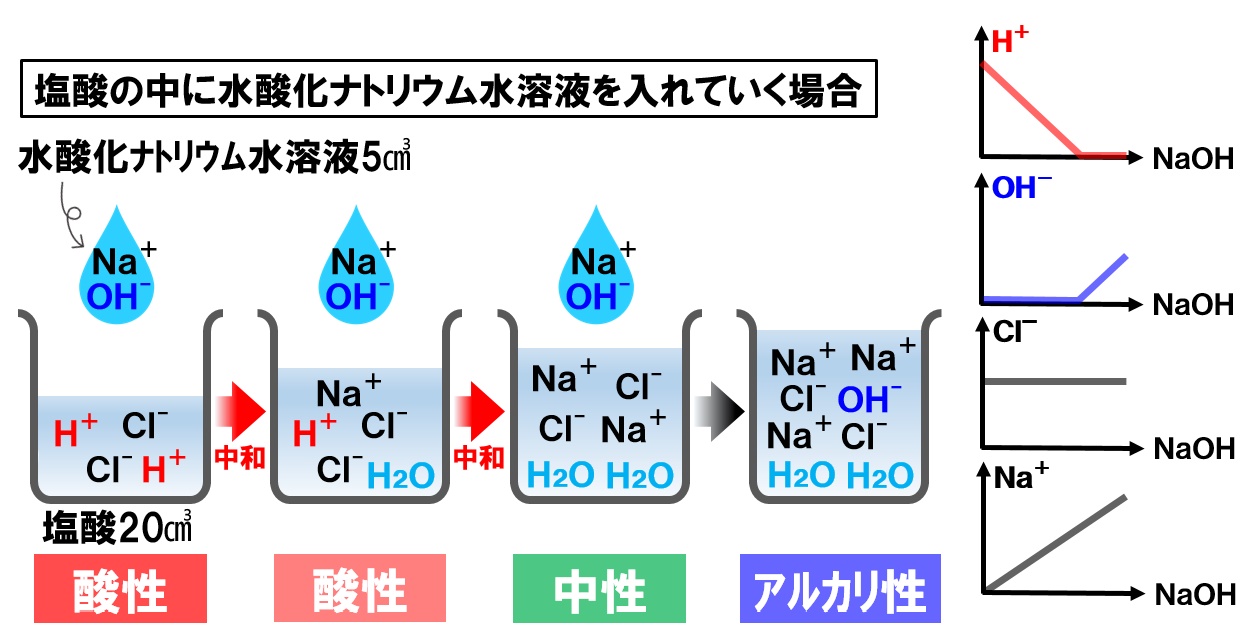
完全に打ち消し合って、中性になったとき、水溶液中には水素イオンH⁺と水酸化物イオンOH⁻がない状態になり、ナトリウムイオンNa⁺と塩化物イオンCl⁻のみがある状態になります。
水酸化ナトリウム水溶液の中に塩酸を入れる場合
今度は逆に、水酸化ナトリウム水溶液の中に塩酸を入れていきます。水酸化ナトリウム水溶液の中には、ナトリウムイオンNa⁺と水酸化物イオンOH⁻が入っています。この中に塩酸の水素イオンH⁺、塩化物イオンCl⁻が入っていきます。
塩酸を水酸化ナトリウム水溶液に入れていくと、各イオンの数は次のように変化していきます。
- 水素イオンH⁺
OH⁻と反応してH₂Oになるので増加しない。
OH⁻がなくなると増加していく - 水酸化物イオンOH⁻
H⁺と反応しして減少していく。 - 塩化物イオンCl⁻
塩酸を入れた分だけ増加していく。 - ナトリウムイオンNa⁺
一定量のまま変化しない。
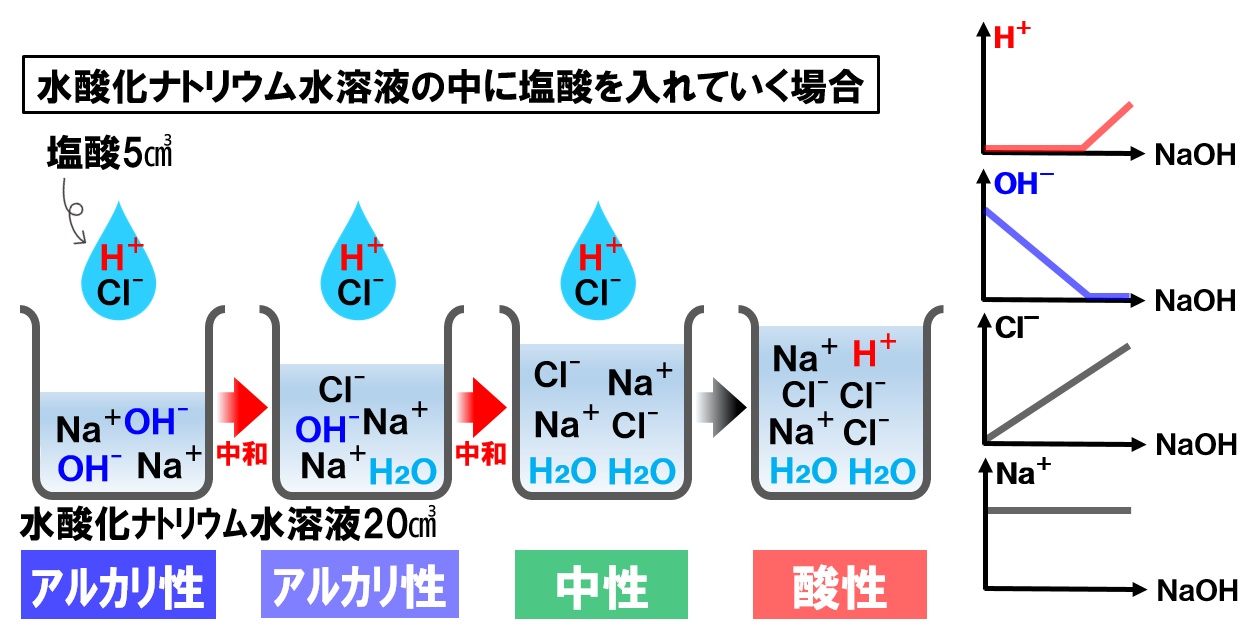
イオンの総数を見てみると、中性になるまでは4つのイオン数で変化がないこともわかります。中性以降は、打ち消し合うイオンが無くなるので、それから先は増加していくことがわかります。
塩酸と水酸化ナトリウム水溶液以外にも、硫酸と水酸化バリウム水溶液の中和などのイオン数の変化も学習してみてください。

コメント