中学3年理科。イオンと化学変化で登場する塩酸の電気分解の説明です。
- レベル★★★☆
- 重要度★★★☆
- ポイント:イオンの移動と電子のやり取り!
授業用まとめプリント下記リンクからダウンロード!
授業用まとめプリント「塩酸の電気分解」
塩酸の電気分解の学習方法
塩酸は、気体の塩化水素が水に溶けた水溶液です。酸性の水溶液であることは、小学校や中学1年生で学習しました。今日は、この塩酸に電圧をかけ、電気分解をする実験を説明します。
まずは、気体の塩化水素が水に溶け塩酸になるようす「塩化水素の電離」をマスターしましょう。次に、塩酸に電圧をかけ気体を発生させる「塩酸の電気分解」をマスターします。最後に、実際の問題でも通用するように、電離の式や化学反応式、発生する気体の性質についてマスターします。
塩化水素の電離
電解質である気体の塩化水素を水に溶かすと、陽イオンと陰イオンに電離します。
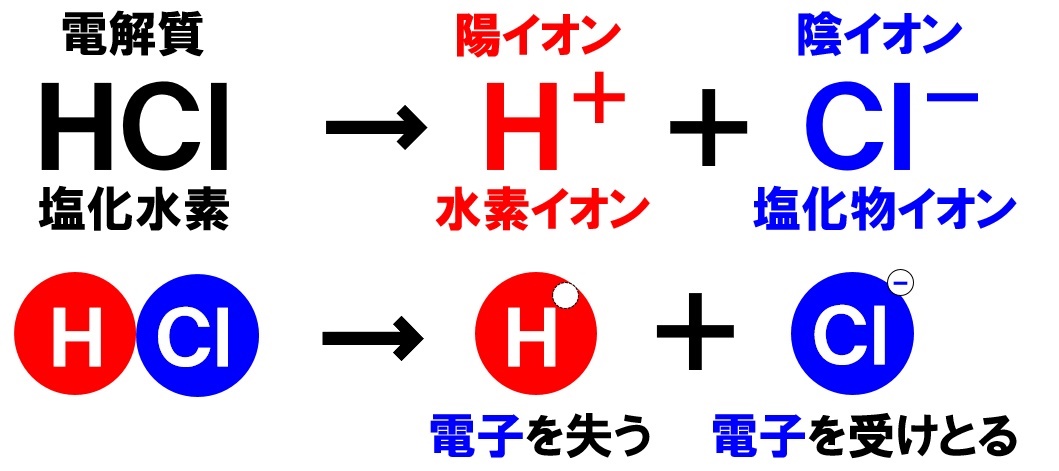
塩化水素の化学式はHClでしたね。化学式の前に書いてある水素Hが電子を失い陽イオンである水素イオンH⁺に、後に書いてある塩素Clが電子を受けとり、陰イオンである塩化物イオンCl⁻に電離します。
これらのイオンが水溶液中にあるのが塩酸です。塩酸の溶質は塩化水素です。
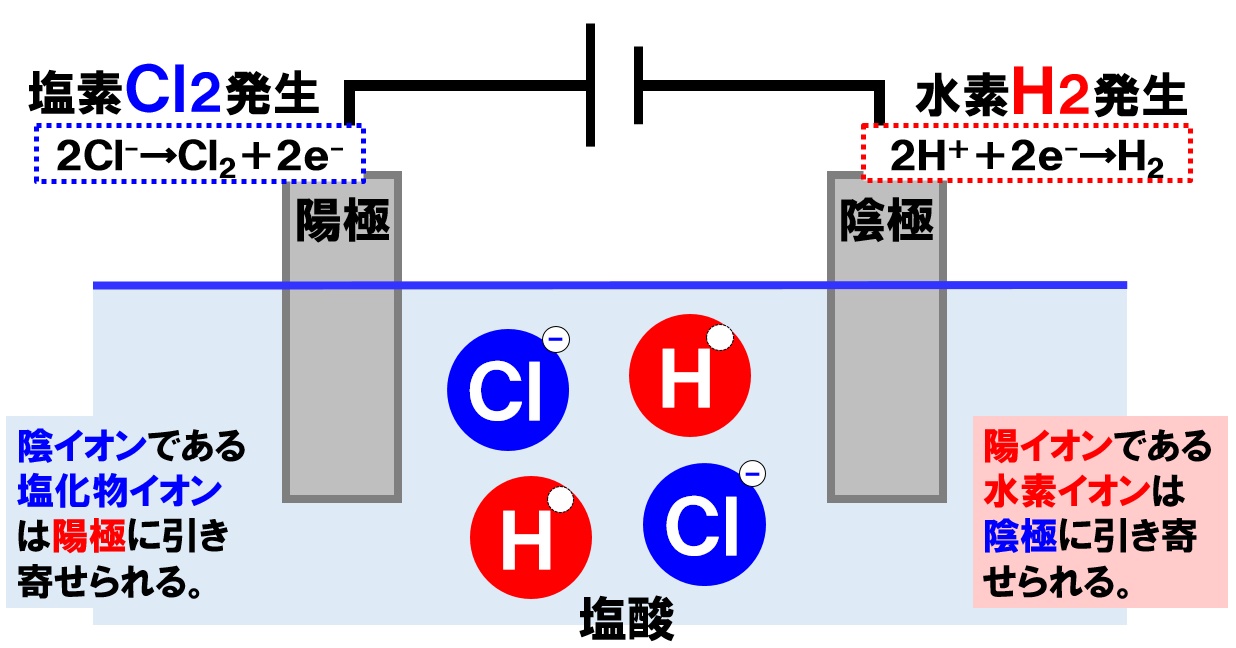
塩酸の電気分解
できた塩酸に電圧をかけ、電気分解を行います。電源装置の+極とつないだ陽極に引き寄せられるイオンは、-の電気を帯びている塩化物イオンCl⁻です。電源装置の-極につないだ陰極に引き寄せられるのイオンは、+の電気を帯びた水素イオンH⁺になります。
陽極での変化
陰イオンである塩化物イオンCl⁻が引き寄せられた陰極では、次のような変化が起こっています。
- 塩化物イオンCl⁻が陽極に引き寄せられる。
- 塩化物イオンCl⁻が陽極に電子e⁻を渡す。
- 塩化物イオンがCl⁻が塩素原子Clに戻る。
- 塩素原子Clが2個くっつき、塩素分子Cl₂になって発生する。
- 陽極の電子e⁻は導線を通って陰極に移動する。
塩化物イオンCl⁻が電子を失って塩素原子Clに戻っていることがポイントです。また、陽極からは塩素Cl₂が発生していることもしっかりと覚えておきましょう。
陰極での変化
陽イオンである水素イオンH⁺が引き寄せられた陽極では、次のような変化が起こっています。
- 水素イオンH⁺が陰極に引き寄せられる。
- 導線を通って電子e⁻が陰極にやってくる。
- 水素イオンH⁺が電子e⁻を受け取り、水素原子Hに戻る。
- 水素原子Hが2個くっついて、水素分子H₂になって発生する。
水素イオンH⁺が電子を受けとって水素原子Hに戻ることがポイントです。また、陰極からは水素H₂が発生することもしっかりと覚えましょう。
塩酸の電気分解の化学反応式
塩酸を電気分解すると、陰極からは水素H₂、陽極からは塩素Cl₂が発生するとわかりました。これを化学反応式で表すと、次のようになります。
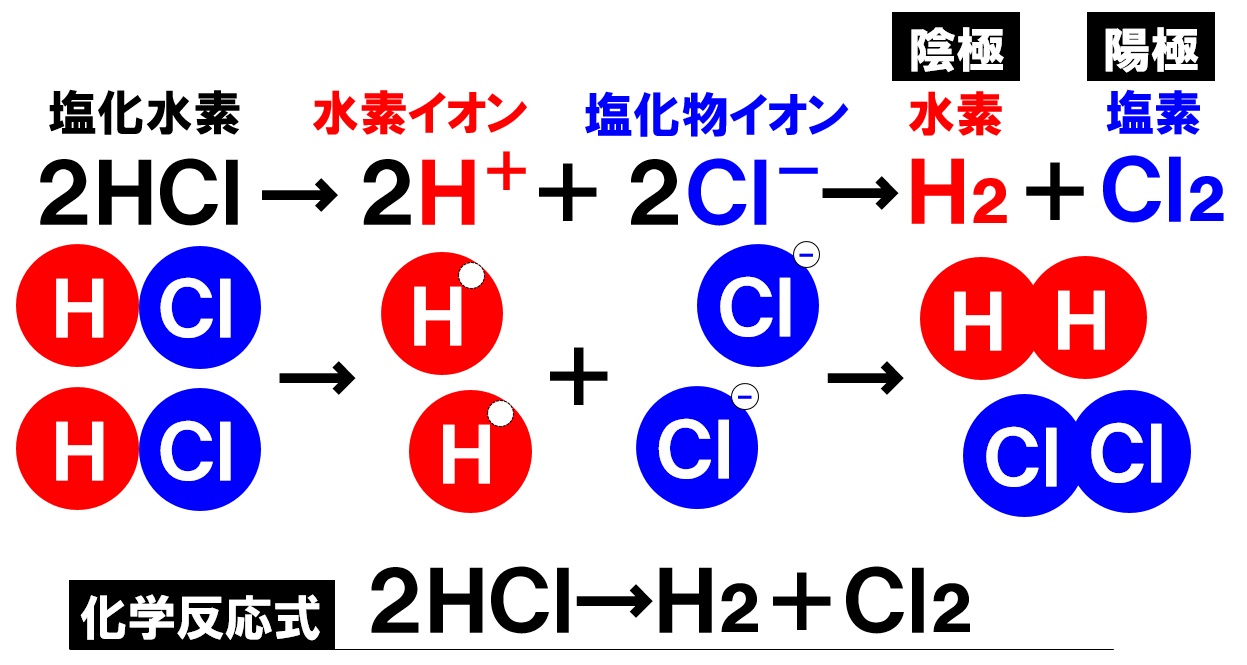
化学変化前の物質である塩化水素HClを左辺に、化学変化後の物質を右辺に書き、原子の個数を合わせると上記の式になります。イオン式は学反応式には登場しないので注意してください。
塩酸の電気分解で発生する気体の性質
塩酸の電気分解で発生する気体の性質もよく聞かれます。水素はこれまで多く登場しましたが、塩素Cl₂が新しく登場しました。性質をしっかり覚えましょう。
- 水素H₂…水に溶けにくい気体。
マッチの火を近づけると、音を立てて燃える。 - 塩素Cl₂…水によく溶ける気体。黄緑色。
赤インクをしみ込ませたろ紙を近づけると、色が抜けて白くなる。
塩素には脱色作用がありますので、色を白くする性質があります。また、水に溶けやすい気体なので、発生しても水に溶け、なかなか気体が溜まりません。

コメント