中学3年理科。中和で生じる沈殿(塩)の計算問題を演習します。
- レベル★★★☆
- 重要度★★☆☆
- ポイント:グラフの完全中和点を求める!
授業用まとめプリントは下記リンクよりダウンロード!
授業用まとめプリント「中和と沈殿の量」
中和と沈殿の量
酸とアルカリの水溶液を混ぜると、お互いの性質を打ち消し合い、塩と水ができる反応が起こります。そうです、中和反応です。この中和反応で、白い沈殿が生じる場合があります。硫酸と水酸化バリウム水溶液の中和反応では、水に溶けにくい塩である硫酸バリウムが生じます。
水に溶けいにくい塩が中和で発生するので、白い沈殿がビーカーの底に沈殿します。この沈殿の量や、完全中和点を求めさせる問題が入試でよく出題されます。
硫酸と水酸化バリウム水溶液の中和
硫酸は、強力な酸性の水溶液です。硫酸の化学式はH₂SO₄になります。水酸化バリウム水溶液も強いアルカリ性の水溶液です。水酸化バリウムの化学式はBa(OH)₂になります。この中和反応式は次のようになります。
- 硫酸+水酸化バリウム水溶液→硫酸バリウム+水
- H₂SO₄+Ba(OH)₂→BaSO₄+H₂O
中和では水と塩が生じます。この中和反応では、水に溶けにくい硫酸バリウムという塩が生じ、白い沈殿となってビーカーの底に沈殿します。また、硫酸バリウムは水に溶けにくい塩ですので、完全中和した場合、水溶液中にイオンが全くない状態になり、電流が流れなくなることも覚えておきましょう。
中和と沈殿量の計算
オーソドックスな計算問題では、沈殿の量を求めさせる問題が多いようです。今日は、この沈殿量を求める計算が出来れように練習していきましょう。
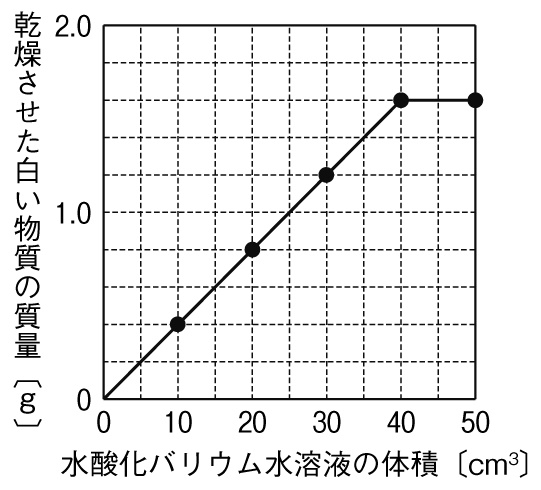
(1)この中和で生じる沈殿は何か。化学式で答えよ。
(2)この硫酸20cm³が完全に中和したとき、生じた沈殿は何gか。
(3)この硫酸50cm³に同じ水酸化バリウム水溶液を加えて、完全に中和したとき、生じる沈殿の質量は何gか。また、完全に中和するのに、水酸化バリウム水溶液は何cm³必要か。
中和と沈殿量の計算 解答・解説
詳しくは、解説動画を確認してください。計算のポイントを説明しています。
(1)BaSO₄
硫酸と水酸化バリウム水溶液の中和反応は次のようになります。
H₂SO₄+Ba(OH)₂→BaSO₄+2H₂O
この中和でできる塩は、水に溶けにくいので、白い沈殿となってビーカーの底に沈殿します。
(2)1.6g
グラフより、うすい硫酸20cm³と過不足なく中和する水酸化バリウム水溶液の体積は40cm³だとわかります。グラフがここで折れ曲がり、これ以上水酸化バリウム水溶液を入れても沈殿が生じないことがわかります。ここで、うすい硫酸20cm³の中にあったイオンがすべて反応したことがわかります。
(3)沈殿:4.0g 水酸化バリウム水溶液:100cm³
グラフより、うすい硫酸20cm³と水酸化バリウム水溶液40cm³が完全に中和し、沈殿(硫酸バリウム)が1.6g生じることがわかります。化学変化で生じる物質の量には比例関係があるので、50cm³の硫酸と過不足なく反応する水酸化バリウム水溶液は、
20:40=50:x
x=100cm³
であると計算できます。このとき生じる沈殿も、
20:1.6=50:x
x=4.0g
であると計算できます。

コメント